GRCh37 (Genome Reference Consortium human build 37) ?
Hg19 (UCSC human genome 19) ?
リファレンス配列、1番から22番+X、Y染色体に関して言えば、配列はどちらも同じです。
そう言われても信じない方もいると思うし、現にヒューマンエラーで多少違うんでは?と思っている方もいるでしょう。
どちらも全く同じ配列だ、ということはUCSCのゲノムブラウザなどで、GRCh37/hg19 と記述されていることから何となく信じている方がほとんどだと思います。
でも、たまにお客さんから、どっちがいいの? 本当に同じ配列なの? と聞かれることもありました。
そういう疑問を持つ方もいるらしく、私はとりあえず、A、T、C、GそれとNの塩基の数がGRCh37とhg19で同じかどうか、染色体ごとに調べてみました。
「とりあえず」というのは、本当は塩基の並び順も調べるべきなのでしょうが、4つの塩基+Nの数が全く同じなら「合っている」としてしまおう、という大雑把な試みだからです。
GRCh37の配列は
ftp://ftp.ncbi.nih.gov/genomes/H_sapiens/Assembled_chromosomes/seq/
から、hs_ref_GRCh37.p5_chr1.fa.gzなどを1番から22番+XとY
Hg19の配列は
http://hgdownload.cse.ucsc.edu/goldenPath/hg19/chromosomes/
から、chr1.fa.gz などを1番から22番+XとY
解凍してfastaファイルにしたら、以下のようなコマンドを実行して塩基の種類と数を得ました。
参考にしたのはこのサイトです。
# UCSCのchr1の場合
tail -n+2 chr1.fa | awk '{ for ( i=1; i<=length; i++ ) arr[substr($0, i, 1)]++ }END{ for ( i in arr ) { print i, arr[i] } }' > hg19_01.txt
A 32485284
N 23970000
C 23064132
T 32559153
G 23070958
a 33085607
c 23960280
g 23945604
t 33109603
# GRCh37のhs_ref_GRCh37.p2_chr1の場合(GRCh37.p5ではなくて.p2でしたね、私が落とした時は。でも同じです。)
tail -n+2 hs_ref_GRCh37.p2_chr1.fa | awk '{ for ( i=1; i<=length; i++ ) arr[substr($0, i, 1)]++ }END{ for ( i in arr ) { print i, arr[i] } }' > GRCh37_01.txt
A 65570891
N 23970000
C 47024412
G 47016562
T 65668756
UCSCのは、塩基の大文字と小文字に分かれていますが、足すとGRCの数と一致することがわかります。
私はこれを、1番から22番+X、Yまで順番に実行して足し算して比べました。
(暇人ではないですよ)
結果、A、T、C、G、Nの数は、3番染色体を除く全ての染色体でUCSCのとGRCのとが一致しました。
唯一つ、3番染色体は、Nの数が違ったのです。
正確には、
60,830,534番目の塩基が、UCSCではN、GRCではM
60,830,763番目と次の塩基が、UCSCではNN、GRCではRR
でした。
以下、ViewerはCLCのGenomics Workbenchを使用
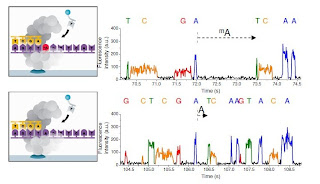
上段がUCSC hg19、下段がGRCh37の3番染色体
NとMが違います。
こちらはNNとRR
ちなみに、これら塩基のある場所は、FHITという遺伝子のイントロン領域でした。
別に、どうってことは無いんでしょうけど、全く同じだと思っていた予想は外れてしまいました。
30億分の3塩基ですからね。
あと個人的に、Nという塩基がどれくらいあるのか気になったので、染色体ごとにグラフにしてみました。 これはGRCh37を基準にしています。
縦軸は塩基の数です。
全体を揃えて%で見るとこんな感じ。
へえー、Yって半分以上がまだNなんだー。